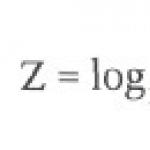В водном растворе среда щелочная в случае. ЦУ (ценные указания)
Вспомните:
Реакция нейтрализации — это реакция между кислотой и щелочью, в результате которой образуются соль и вода;
Под чистой водой химики понимают химически чистую воду, не содержащую никаких примесей и растворенных солей, т. е. дистиллированную воду.
Кислотность среды
Для различных химических, промышленных и биологических процессов очень важной характеристикой является кислотность растворов, характеризующая содержание кислот или щелочей в растворах. Поскольку кислоты и щелочи являются электролитами, то для характеристики кислотности среды используют содержание ионов H+ или OH - .
В чистой воде и в любом растворе вместе с частицами растворенных веществ присутствуют также ионы H+ и OH - . Это происходит благодаря диссоциации самой воды. И хотя мы считаем воду неэлектролитом, тем не менее она может диссоциировать: H 2 O ^ H+ + OH - . Но этот процесс происходит в очень незначительной степени: в 1 л воды на ионы распадается только 1 . 10 -7 моль молекул.
В растворах кислот в результате их диссоциации появляются дополнительные ионы H+. В таких растворах ионов H+ значительно больше, чем ионов OH - , образовавшихся при незначительной диссоциации воды, поэтому эти растворы называют кислотными (рис. 11.1, слева). Принято говорить, что в таких растворах кислотная среда. Чем больше ионов H+ содержится в растворе, тем больше кислотность среды.
В растворах щелочей в результате диссоциации, наоборот, преобладают ионы OH - , а катионы H+ ввиду незначительной диссоциации воды почти отсутствуют. Среда таких растворов щелочная (рис. 11.1, справа). Чем выше концентрация ионов OH - , тем более щелочной является среда раствора.
В растворе поваренной соли количество ионов H+ и OH - одинаково и равно 1 . 10 -7 моль в 1 л раствора. Такую среду называют нейтральной (рис. 11.1, по центру). Фактически это означает, что раствор не содержит ни кислоты, ни щелочи. Нейтральная среда характерна для растворов некоторых солей (образованных щелочью и сильной кислотой) и многих органических веществ. У чистой воды также нейтральная среда.
Водородный показатель
Если сравнивать вкус кефира и лимонного сока, то можно смело утверждать, что лимонный сок намного кислее, т. е. кислотность этих растворов разная. Вы уже знаете, что в чистой воде также содержатся ионы H+, но кислого вкуса воды не ощущается. Это объясняется слишком малой концентрацией ионов H+. Часто бывает недостаточно сказать, что среда кислотная или щелочная, а необходимо количественно ее охарактеризовать.
Кислотность среды количественно характеризуют водородным показателем pH (произносится «пэ-аш»), связанным с концентрацией
ионов Гидрогена. Значение pH соответствует определенному содержанию катионов Гидрогена в 1 л раствора. В чистой воде и в нейтральных растворах в 1 л содержится 1 . 10 7 моль ионов H+, а значение pH равно 7. В растворах кислот концентрация катионов H+ больше, чем в чистой воде, а в щелочных растворах меньше. В соответствии с этим меняется и значение водородного показателя pH: в кислотной среде он находится в пределах от 0 до 7, а в щелочных — от 7 до 14. Впервые водородный показатель предложил использовать датский химик Педер Сёренсен.
Вы могли заметить, что значение pH связано с концентрацией ионов H+. Определение pH напрямую связано с вычислением логарифма числа, которое вы будете изучать на уроках математики в 11 классе. Но взаимосвязь между содержанием ионов в растворе и значением pH можно проследить по следующей схеме:


Значение рН водных растворов большинства веществ и природных растворов находится в интервале от 1 до 13 (рис. 11.2).

Рис. 11.2. Значение рН различных природных и искусственных растворов

Сёрен Педер Лауриц Сёренсен
Датский физико-химик и биохимик, президент Датского королевского общества. Окончил Копенгагенский университет. В 31 год стал профессором Датского политехнического института. Возглавлял престижную физико-химическую лабораторию при пивоваренном заводе Карлсберга в Копенгагене, где сделал свои главные научные открытия. Основная научная деятельность посвящена теории растворов: он ввел понятие о водородном показателе (рН), изучал зависимость активности ферментов от кислотности растворов. За научные достижения Сёренсен внесен в перечень «100 выдающихся химиков XX века», но в истории науки он остался прежде всего как ученый, который ввел понятия «рН» и «рН-метрия».
Определение кислотности среды
Для определения кислотности раствора в лабораториях чаще всего используют универсальный индикатор (рис. 11.3). По его окраске можно определить не только наличие кислоты или щелочи, но и значение рН раствора с точностью до 0,5. Для более точного измерения рН существуют специальные приборы — рН-метры (рис. 11.4). Они позволяют определить рН раствора с точностью до 0,001-0,01.
Используя индикаторы или рН-метры, можно следить за тем, как протекают химические реакции. Например, если к раствору натрий гидроксида приливать хлоридную кислоту, то произойдет реакция нейтрализации:

Рис. 11.3. Универсальным индикатором определяют приблизительное значение рН

Рис. 11.4. Для измерения pH растворов используют специальные приборы — рН-метры: а — лабораторный (стационарный); б — портативный
В этом случае растворы реагентов и продуктов реакции бесцветны. Если же в исходный раствор щелочи поместить электрод рН-метра, то о полной нейтрализации щелочи кислотой можно судить по значению рН образованного раствора.
Применение водородного показателя
Определение кислотности растворов имеет большое практическое значение во многих областях науки, промышленности и других сферах жизни человека.
Экологи регулярно измеряют рН дождевой воды, воды рек и озер. Резкое повышение кислотности природных вод может быть следствием загрязнения атмосферы или попадания в водоемы отходов промышленных предприятий (рис. 11.5). Такие изменения влекут за собой гибель растений, рыбы и других обитателей водоемов.
Водородный показатель очень важен для изучения и наблюдения процессов, происходящих в живых организмах, т. к. в клетках протекают многочисленные химические реакции. В клинической диагностике определяют pH плазмы крови, мочи, желудочного сока и др. (рис. 11.6). Нормальное значение pH крови — от 7,35 до 7,45. Даже небольшое изменение pH крови человека вызывает серьезные заболевания, а при рН = 7,1 и ниже начинаются необратимые изменения, которые могут привести к смерти.
Для большинства растений важна кислотность почвы, поэтому агрономы заранее проводят анализ почв, определяя их рН (рис. 11.7). Если кислотность слишком велика для определенной культуры, почву известкуют — добавляют мел или известь.
В пищевой промышленности при помощью кислотно-основных индикаторов проводят контроль качества продуктов питания (рис. 11.8). Например, в норме для молока pH = 6,8. Отклонение от этого значения свидетельствует либо о наличии посторонних примесей, либо о его скисании.

Рис. 11.5. Влияние уровня pH воды в водоемах на жизнедеятельность растений в них

Важным является значение pH для косметических средств, которые мы используем в быту. В среднем для кожи человека pH = 5,5. Если кожа контактирует со средствами, кислотность которых существенно отличается от этого значения, то это влечет преждевременное старение кожи, ее повреждение или воспаление. Было замечено, что у прачек, которые длительное время использовали для стирки обычное хозяйственное мыло (pH = 8-10) или стиральную соду (Na 2 CO 3 , pH = 12-13), кожа рук становилась очень сухой и покрывалась трещинами. Поэтому очень важно использовать различные косметические средства (гели, кремы, шампуни и т. д.) с pH, близким к естественному pH кожи.
ЛАБОРАТОРНЫЕ ОПЫТЫ № 1-3
Оборудование: штатив с пробирками, пипетка.
Реактивы: вода, хлоридная кислота, растворы NaCl, NaOH, столовый уксус, универсальный индикатор (раствор или индикаторная бумага), пищевые продукты и косметическая продукция (например, лимон, шампунь, зубная паста, стиральный порошок, газированные напитки, соки и т. д.).
Правила безопасности:
Для опытов используйте небольшие количества реактивов;
Остерегайтесь попадания реактивов на кожу, в глаза; при попадании едкого вещества смойте его большим количеством воды.
Определение ионов Гидрогена и гидроксид-ионов в растворах. Установление приблизительного значения pH воды, щелочных и кислых растворов
1. В пять пробирок налейте по 1-2 мл: в пробирку № 1 — воды, № 2 — хлоридной кислоты, № 3 — раствора натрий хлорида, № 4 — раствора натрий гидроксида и № 5 — столового уксуса.
2. В каждую пробирку добавьте по 2-3 капли раствора универсального индикатора или опустите индикаторную бумагу. Определите pH растворов, сравнивая цвет индикатора по эталонной шкале. Сделайте выводы о наличии в каждой пробирке катионов Гидрогена или гидроксид-ионов. Составьте уравнения диссоциации этих соединений.
Исследование pH пищевой и косметической продукции
Испытайте универсальным индикатором образцы пищевых продуктов и косметической продукции. Для исследования сухих веществ, например, стирального порошка, их необходимо растворить в небольшом количестве воды (1 шпатель сухого вещества на 0,5-1 мл воды). Определите pH растворов. Сделайте выводы о кислотности среды в каждом из исследованных продуктов.
Ключевая идея

Контрольные вопросы
130. Наличием каких ионов в растворе обусловлена его кислотность?
131. Какие ионы содержатся в избытке в кислотных растворах? в щелочных?
132. Какой показатель количественно описывает кислотность растворов?
133. Каково значение рН и содержание ионов H+ в растворах: а) нейтральных; б) слабокислотных; в) слабощелочных; г) сильнокислотных; д) сильнощелочных?
Задания для усвоения материала
134. Водный раствор некоторого вещества имеет щелочную среду. Каких ионов больше в этом растворе: H+ или OH - ?
135. В двух пробирках находятся растворы нитратной кислоты и нитрата калия. Какие индикаторы можно использовать для определения, в какой пробирке содержится раствор соли?
136. В трех пробирках находятся растворы барий гидроксида, нитратной кислоты и кальций нитрата. Как с помощью одного реактива распознать эти растворы?
137. Из приведенного перечня выпишите отдельно формулы веществ, растворы которых имеют среду: а) кислотную; б) щелочную; в) нейтральную. NaCl, HCl, NaOH, HNO 3 , H 3 PO 4 , H 2 SO 4 , Ba(OH) 2 , H 2 S, KNO 3 .
138. Дождевая вода имеет рН = 5,6. Что это означает? Какое вещество, содержащееся в воздухе, при растворении в воде определяет такую кислотность среды?
139. Какая среда (кислотная или щелочная): а) в растворе шампуня (рН = 5,5);
б) в крови здорового человека (рН = 7,4); в) в желудочном соке человека (рН = 1,5); г) в слюне (рН = 7,0)?
140. В составе каменного угля, используемого на теплоэлектростанциях, содержатся соединения Нитрогена и Сульфура. Выброс в атмосферу продуктов сжигания угля приводит к образованию так называемых кислотных дождей, содержащих небольшие количества нитратной или сульфитной кислот. Какие значения рН характерны для такой дождевой воды: больше 7 или меньше 7?
141. Зависит ли рН раствора сильной кислоты от ее концентрации? Ответ обоснуйте.
142. К раствору, содержащему 1 моль калий гидроксида, прилили раствор фенолфталеина. Изменится ли окраска этого раствора, если к нему добавить хлоридную кислоту количеством вещества: а) 0,5 моль; б) 1 моль;
в) 1,5 моль?
143. В трех пробирках без надписей находятся бесцветные растворы натрий сульфата, натрий гидроксида и сульфатной кислоты. Для всех растворов измерили значение рН: в первой пробирке — 2,3, во второй — 12,6, в третьей — 6,9. В какой пробирке содержится какое вещество?
144. Ученик купил в аптеке дистиллированную воду. рН-метр показал, что значение рН этой воды равно 6,0. Затем ученик прокипятил эту воду в течение длительного времени, заполнил контейнер до верха горячей водой и закрыл крышкой. Когда вода остыла до комнатной температуры, рН-метр определил значение 7,0. После этого ученик трубочкой пропускал воздух через воду, и рН-метр снова показал 6,0. Как можно объяснить результаты этих измерений рН?
145. Как вы считаете, почему в двух бутылках уксуса от одного производителя могут содержаться растворы с несколько различными значениями рН?
Это материал учебника
Гидролиз солей
Тема «Гидролиз солей» – одна из наиболее трудных для учащихся 9-го класса, изучающих неорганическую химию. И как думается, трудность ее не в действительной сложности самого изучаемого материала, а в том, как он излагается в учебниках. Так, у Ф.Г.Фельдмана и Г.Е.Рудзитиса из соответствующего параграфа очень мало, что можно понять. В учебниках же Л.С.Гузея и Н.С.Ахметова данная тема вообще исключена, хотя учебник Ахметова предназначен для учащихся 8–9-х классов с углубленным изучением химии.
Пользуясь учебниками указанных авторов, ученик вряд ли сможет хорошо понять теорию растворов, сущность электролитической диссоциации веществ в водной среде, соотнести реакции ионного обмена с реакциями гидролиза солей, образованных разными по силе кислотами и основаниями. Кроме того, в конце каждого учебника имеется таблица растворимости, но нигде и никак не поясняется, почему в отдельных ее клеточках стоят прочерки, а в текстах учебников ученики встречают формулы этих солей.
Мы попытаемся в краткой лекции для учителей (прежде всего для начинающих, им особенно трудно отвечать на возникающие у детей вопросы) восполнить данный пробел и по-своему осветить проблему составления уравнений реакций гидролиза и определения характера образующейся среды.
Гидролизом называется процесс разложения
веществ водой (само слово «гидролиз» об этом
говорит: греч. –
вода и –
разложение). Разные авторы, давая определение
этому явлению, выделяют, что при этом
образуется кислота или кислая соль, основание
или основная соль
(Н.Е.Кузьменко); при
взаимодействии ионов соли с водой образуется
слабый электролит
(А.Э.Антошин); в результате
взаимодействия ионов соли с водой смещается
равновесие электролитической диссоциации воды
(А.А.Макареня);
составные части растворенного вещества
соединяются с составными частями воды
(Н.Л.Глинка) и т.д.
Каждый автор, давая определение гидролиза,
отмечает наиболее важную, на его взгляд, сторону
этого сложного, многогранного процесса. И каждый
из них по-своему прав. Думается, дело учителя,
какому определению отдать предпочтение – что
ему ближе по его образу мышления.
Итак, гидролиз – это разложение веществ водой.
Причиной его является электролитическая
диссоциация соли и воды на ионы и взаимодействие
между ними. Вода диссоциирует незначительно на
ионы Н + и ОН – ( 1
молекула из 550 000), причем в процессе гидролиза
один или оба этих иона могут связываться с
ионами, образующимися при диссоциации соли, в
малодиссоциирующее, летучее или нерастворимое в
воде вещество.
Соли, образованные сильными основаниями (NаОН,
КОH, Ва(ОH) 2) и сильными кислотами (Н 2 SO 4 ,
HCl, НNO 3), гидролизу не подвергаются, т.к.
образующие их катионы и анионы не способны в
растворах связывать ионы Н + и ОН –
(причина – высокая диссоциация).
Когда соль образована слабым основанием или
слабой кислотой или оба «родителя» – слабые,
соль в водном растворе подвергается гидролизу.
При этом реакция среды зависит от относительной
силы кислоты и основания. Другими словами, водные
растворы таких солей могут быть нейтральными,
кислыми или щелочными в зависимости от констант
диссоциации образующихся новых веществ.
Так, при диссоциации ацетата аммония СН 3 СООNН 4
реакция раствора будет слабощелочной, т.к.
константа диссоциации NН 4 ОН (k
дис =
6,3 10 –5) больше константы диссоциации СН 3 СООН
(k
дис = 1,75 10 –5). У другой же соли
уксусной кислоты – ацетата алюминия (СН 3 СОО) 3 Al
– реакция раствора будет слабокислой, т.к. k
дис (СН 3 СООН)
= 1,75 10 –5 больше k
дис (Al(ОН) 3) =
1,2 10 –6 .
Реакции гидролиза в одних случаях являются
обратимыми, а в других – идут до конца.
Количественно гидролиз характеризуется
безразмерной величиной г, называемой степенью гидролиза и
показывающей, какая часть от общего количества
молекул соли, находящихся в растворе,
подвергается гидролизу:
Г = n /N 100%,
где n – число гидролизованных молекул, N – общее число молекул в данном растворе. Например, если г = 0,1%, то это означает, что из 1000 молекул соли водой разложилась только одна:
n = г N /100 = 0,1 1000/100 = 1.
Степень гидролиза зависит от температуры,
концентрации раствора и природы растворенного
вещества. Так, если рассмотреть гидролиз cоли СН 3 СООNа,
то степень ее гидролиза для растворов различной
концентрации будет следующая: для 1М раствора –
0,003%, для 0,1М – 0,01%, для
0,01М – 0,03%, для 0,001М – 0,1% (данные взяты из книги
Г.Реми). Эти значения согласуются с принципом Ле
Шателье.
Повышение температуры увеличивает кинетическую
энергию молекул, их распад на катионы и анионы и
взаимодействие с ионами воды (Н + и ОН –)
– слабого при комнатной температуре
электролита.
Учитывая природу реагирующих веществ, для
связывания ионов ОН – к раствору соли можно
добавить кислоту, а для связывания ионов Н +
– щелочь. Можно также добавить другие соли,
гидролизующиеся по противоположному иону. В этом
случае происходит взаимное усиление гидролиза
обеих солей.
Ослабить гидролиз можно (если это необходимо)
понижением температуры, увеличением
концентрации раствора, введением в него одного
из продуктов гидролиза: кислоты, если при
гидролизе накапливаются ионы Н + , или
щелочи, если накапливаются ионы ОН – .
Все реакции нейтрализации протекают
экзотермически, а гидролиза – эндотермически.
Поэтому выход первых с повышением температуры
уменьшается, а вторых – увеличивается.
Ионы Н + и ОН – не могут существовать в
растворе в значительных концентрациях – они
соединяются в молекулы воды, смещая равновесие
вправо.
Разложение соли водой объясняется связыванием
катионов и/или анионов диссоциированной соли в
молекулы слабого электролита ионами воды (Н +
и/или ОН –), всегда имеющимися в растворе.
Образование слабого электролита, осадка, газа
или полное разложение нового вещества
равноценно удалению ионов соли из раствора, что в
соответствии с принципом Ле Шателье (действие
равно противодействию) смещает равновесие
диссоциации соли вправо, а следовательно,
приводит к разложению соли до конца. Отсюда и
появляются прочерки в таблице растворимости
против ряда соединений.
Если молекулы слабого электролита образуются за
счет катионов соли, то говорят, что гидролиз идет
по катиону и среда будет кислая, а если за счет
анионов соли, то говорят, что гидролиз идет по
аниону и среда будет щелочная. Иными словами, кто
сильнее – кислота или основание, – тот и
определяет среду.
Гидролизу подвергаются только растворимые соли
слабых кислот и/или оснований. Дело в том, что
если соль малорастворима, то концентрации ее
ионов в растворе ничтожно малы и говорить о
гидролизе такой соли не имеет смысла.
Составление уравнений реакций гидролиза солей
Гидролиз солей слабых многоосновных оснований
и/или кислот происходит ступенчато. Число
ступеней гидролиза равно наибольшему заряду
одного из ионов соли.
Например:

Однако гидролиз по второй ступени и особенно по
третьей идет очень слабо, поскольку
г1 >> г2 >> г3 . Поэтому
при написании уравнений гидролиза обычно
ограничиваются первой ступенью. Если гидролиз
практически завершается на первой ступени, то
при гидролизе солей слабых многоосновных
оснований и сильных кислот образуются основные
соли, а при гидролизе солей сильных оснований и
слабых многоосновных кислот образуются кислые
соли.
Количество молекул воды, участвующих в
процессе гидролиза соли по схеме реакции,
определяется произведением валентности катиона
на число его атомов в формуле соли
(правило автора).
Например:
Nа 2 СО 3 2Na + 1 2 = 2 (H 2 O),
Al 2 (SО 4) 3 2Al 3+ 3 2 = 6 (H 2 O),
Co(CH 3 COO) 2 Со 2+ 2 1 = 2 (H 2 O).
Поэтому при составлении уравнения гидролиза пользуемся следующим алгоритмом (на примере гидролиза Al 2 (SО 4) 3):
1. Определяем, из каких веществ образована соль:
2. Предполагаем, как мог бы пойти гидролиз:
Al 2 (SО 4) 3 + 6Н–ОН = 2Аl 3+ + 3 + 6H + + 6OH – .
3. Поскольку Al(ОН) 3 – слабое основание и его катион Al 3+ связывают ионы ОН – из воды, то процесс фактически идет так:
Al 2 (SO 4) 3 + 6Н + + 6OH – = 2Аl(ОН) 2+ + 3 + 6H + + 2OH – .
4. Сопоставляем количества оставшихся в растворе ионов Н + и ОН – и определяем реакцию среды:
5. После гидролиза образовалась новая соль: (Al(ОН) 2) 2 SО 4 , или Аl 2 (ОН) 4 SO 4 , – дигидроксосульфат алюминия (или тетрагидроксосульфат диалюминия) – основная соль. Частично может образоваться и AlОНSО 4 (гидроксосульфат алюминия), но в значительно меньшем количестве, и им можно пренебречь.
Другой пример:
2. Na 2 SiO 3 + 2Н 2 О = 2Na + + + 2Н + + 2ОН – .
3. Поскольку Н 2 SiO 3 – слабая кислота и ее ион связывает ионы Н + из воды, то фактически реакция идет так:
2Na + + + 2Н + + 2ОН – = 2Na + + Н + Н + + 2ОН – .
4. Н + + 2ОН – = Н 2 О + ОН – щелочная среда.
5. Na + + Н = NаНSiO 3 – гидросиликат натрия – кислая соль.
Кислотность или щелочность среды легко
определить по количеству оставшихся в растворе
ионов Н + или ОН – при условии, что
новые вещества образовались и существуют в
растворе в эквивалентных отношениях и другие
реактивы в ходе реакции не добавлялись. Среда
может быть кислая или слабокислая (если ионов Н +
мало), щелочная (если ионов ОН – много) или
слабощелочная, а также нейтральная, если
значения констант диссоциации слабой кислоты и
слабого основания близки и все оставшиеся в
растворе ионы Н + и ОН – после
гидролиза снова соединились с образованием Н 2 О.
Мы уже отмечали, что степень гидролиза соли тем
больше, чем слабее кислота или основание,
образовавшие эту соль. Поэтому необходимо для
помощи учащимся привести ряды анионов и
катионов, соответствующие уменьшению силы
кислот и оснований их образующих (по
А.В.Метельскому).
| Анионы:
F – > > CH 3 COO – > H > HS – > > > > > . |
| Катионы:
Сd 2+ > Mg 2+ > Mn 2+ > Fe 2+ > Co 2+ > Ni 2+ > > Cu 2+ > Pb 2+ > Zn 2+ > Al 2+ > Cr 2+ > Fe 2+ . |
Чем правее в этих рядах расположен ион, тем с
большей силой идет гидролиз образованной им
соли, т.е. его основание или кислота cлабее, чем у
стоящих слева от него. Особенно сильно идет
гидролиз солей, образованных одновременно
слабыми основанием и кислотой. Но даже для них
степень гидролиза обычно не превышает 1%. Тем не
менее в некоторых случаях гидролиз таких солей
протекает особенно сильно и степень гидролиза
достигает почти 100%. Такие соли в водных растворах
не существуют, а хранятся только в сухом виде. В
таблице растворимости против них стоит прочерк.
Примерами таких солей могут служить ВаS, Аl 2 S 3 ,
Сr 2 (SO 3) 3 и другие (см. таблицу
растворимости в учебниках).
Подобные соли, имеющие высокую степень
гидролиза, гидролизуются полностью и необратимо,
т. к. продукты их гидролиза выводятся из раствора
в виде малорастворимого, нерастворимого,
газообразного (летучего), малодиссоциирующего
вещества или разлагаются водой на другие
вещества.
Например:

Соли, полностью разлагаемые водой, нельзя получить реакцией ионного обмена в водных растворах, т.к. вместо ионного обмена более активно протекает реакция гидролиза.
Например:
2АlCl 3 + 3Na 2 S Аl 2 S 3 + 6NaCl (так могло бы быть),
2АlCl 3 + 3Na 2 S + 6H 2 O 2Al(OH) 3 + 3H 2 S + 6NaCl (так есть фактически).
Соли, подобные Al 2 S 3 , получают в безводных средах спеканием компонентов в эквивалентных количествах или другими способами:
![]()
Многие галогениды, как правило, активно
реагируют с водой, образуя гидрид одного
элемента и гидроксид другого.
Например:
СlF + H–OH HClO + HF,
PСl 3 + 3H–OH
P(OH) 3 + 3HCl
(по Л.Полингу).
Как правило, при такого рода реакциях, также
называемых гидролизом, более
электроотрицательный элемент соединяется с Н + ,
а менее электроотрицательный – с ОН – .
Легко заметить, что приведенные выше реакции
протекают в соответствии с этим правилом.
Кислые соли слабых кислот также подвергаются
гидролизу. Однако в этом случае наряду с
гидролизом протекает диссоциация кислотного
остатка. Так, в растворе NaHCО 3 одновременно
протекают гидролиз H, приводящий к
накоплению ОH – -ионов:
Н + Н–ОН Н 2 СО 3 + ОH – ,
и диссоциация, хотя и незначительная:
Н + H + .
Таким образом, реакция раствора кислой соли
может быть как щелочной (если гидролиз аниона
преобладает над его диссоциацией), так и кислой (в
обратном случае). Это определяется соотношением
константы гидролиза соли (К
гидр) и
константы диссоциации (К
дис)
соответствующей кислоты. В рассмотренном
примере К
гидр аниона больше К
дис
кислоты, поэтому раствор данной кислой соли
имеет щелочную реакцию (что и используют
страдающие изжогой от повышенной кислотности
желудочного сока, хотя делают это зря). При
обратном соотношении констант, например в случае
гидролиза NaHSO 3 , реакция раствора будет
кислой.
Гидролиз основной соли, например
гидроксохлорида меди(II), протекает так:
Сu(ОН)Сl + Н–ОН Сu(ОН) 2 + НСl,
или в ионном виде:
СuОН + + Сl – + H + + ОH – Сu(ОН) 2 + Cl – + H + среда кислая.
Гидролиз в широком смысле – это реакции
обменного разложения между различными
веществами и водой (Г.П.Хомченко). Такое
определение охватывает гидролиз всех соединений
– как неорганических (солей, гидридов,
галогенидов, халькогенов и др.), так и
органических (сложных эфиров, жиров, углеводов,
белков и др.).
Например:

(C 6 H 10 O 5)n + n H–OH n C 6 H 12 O 6 ,
CaC 2 + 2H–OH Ca(OH) 2 + C 2 H 2 ,
Cl 2 + H–OH HCl + HClO,
PI 3 + 3H–OH H 3 PO 3 + 3HI.
В результате гидролиза минералов –
алюмосиликатов – происходит разрушение горных
пород. Гидролиз некоторых солей – Na 2 CO 3 ,
Na 3 РО 4 – применяется для очистки воды
и уменьшения ее жесткости.
Растущая быстрыми темпами гидролизная отрасль
промышленности вырабатывает из отходов
(древесные опилки, хлопковая шелуха,
подсолнечная лузга, солома, кукурузные
кочерыжки, отходы сахарной свеклы и др.) ряд
ценных продуктов: этиловый спирт, кормовые
дрожжи, глюкозу, «сухой лед», фурфурол, метанол,
лигнин и многие другие вещества.
Гидролиз протекает в организме человека и
животных при переваривании пищи (жиров,
углеводов, белков) в водной среде под действием
ферментов – биологических катализаторов. Он
играет важную роль в ряде химических превращений
веществ в природе (цикл Кребса, цикл
трикарбоновых кислот) и промышленности. Поэтому
нам думается, что вопросам изучения гидролиза в
школьном курсе химии необходимо уделять
значительно больше внимания.
Ниже приведен пример раздаточной карточки
,
предлагаемой учащимся для закрепления материала
после изучения темы «Гидролиз солей» в 9-м классе.
Алгоритм написания уравнения гидролиза Fe 2 (SO 4) 31. Определяем, чем образована соль:
2. Предполагаем, как мог бы пойти гидролиз: Fe 2 (SO 4) 3 + 6Н 2 О = 2Fe 3+ + 3 + 6H + + 6OH – . 3. Поскольку Fe(OH) 3 – слабое основание, то катионы Fe 3+ будут связываться анионами ОН – из воды и гидролиз фактически будет протекать так: 2Fе 3+ + 3 + 6H + + 6OH – = 2Fe(OH) 2+ + 3 + 6H + + 2OH – . 4. Определяем реакцию среды: 6Н + + 2ОН – = 2Н 2 О + 4Н + кислая среда. 5. Определяем новую соль по ионам, оставшимся в растворе: 2Fe(OH) 2+ + = 2 SO 4 –
дигидроксосульфат железа(III) Гидролиз идет по катиону. |
Дополнительная информация
|
Применение данного алгоритма способствует осознанному написанию учащимся уравнений гидролиза и при достаточной тренировке не вызывает никаких затруднений.
ЛИТЕРАТУРА
Антошин А.Э., Цапок П.И. Химия. М.: Химия, 1998;
Ахметов Н.С
. Неорганическая химия. М.:
Просвещение, 1990;
Глинка Н.Л.
Общая химия. Л.: Химия, 1978;
Еремин В.В., Кузьменко Н.Е.
Химия. М.: Экзамен,
1998;
Еремин В.В., Кузьменко Н.Е., Попов В.А
. Химия. М.:
Дрофа, 1997;
Кузьменко Н.Е., Чуранов С.С.
Общая и
неорганическая химия. М.: Изд-во МГУ, 1977;
Метельский А.В.
Химия. Минск: Белорусская
энциклопедия, 1997;
Полинг Л., Полинг П
. Химия. М.: Мир, 1998;
Пиментел Д.С.
Химия. М.: Мир, 1967;
Фельдман Ф.Г., Рудзитис Г.Е.
Химия-9. М.:
Просвещение, 1997;
Холин Ю.В., Слета Л.А.
Репетитор по химии.
Харьков: Фолино, 1998;
Хомченко Г.П
. Химия. М.: Высшая школа, 1998.
Для того, чтобы понять, что такое гидролиз солей, вспомним для начала, как диссоциируют кислоты и щелочи.
Общим между всеми кислотами является то, что при их диссоциации обязательно образуются катионы водорода (Н +), при диссоциации же всех щелочей всегда образуются гидроксид-ионы (ОН −).
В связи с этим, если в растворе, по тем или иным причинам, больше ионов Н + говорят, что раствор имеет кислую реакцию среды, если ОН − — щелочную реакцию среды.
Если с кислотами и щелочами все понятно, то какая же реакция среды будет в растворах солей?
На первый взгляд, она всегда должна быть нейтральной. И правда же, откуда, например, в растворе сульфида натрия взяться избытку катионов водорода или гидроксид-ионов. Сам сульфид натрия при диссоциации не образует ионов ни одного, ни другого типа:
Na 2 S = 2Na + + S 2-
Тем не менее, если бы перед вами оказались, к примеру, водные растворы сульфида натрия, хлорида натрия, нитрата цинка и электронный pH-метр (цифровой прибор для определения кислотности среды) вы бы обнаружили необычное явление. Прибор показал бы вам, что рН раствора сульфида натрия больше 7, т.е. в нем явный избыток гидроксид-ионов. Среда раствора хлорида натрия оказалась бы нейтральной (pH = 7), а раствора Zn(NO 3) 2 кислой.
Единственное, что соответствует нашим ожиданиям – это среда раствора хлорида натрия. Она оказалась нейтральной, как и предполагалось.
Но откуда же взялся избыток гидроксид-ионов в растворе сульфида натрия, и катионов-водорода в растворе нитрата цинка?
Попробуем разобраться. Для этого нам нужно усвоить следующие теоретические моменты.
Любую соль можно представить как продукт взаимодействия кислоты и основания. Кислоты и основания делятся на сильные и слабые. Напомним, что сильными называют те кислоты, и основания, степень диссоциации, которых близка к 100%.
примечание: сернистую (H 2 SO 3) и фосфорную (H 3 PO 4) чаще относят к кислотам средней силы, но при рассмотрении заданий по гидролизу нужно относить их к слабым.
Кислотные остатки слабых кислот, способны обратимо взаимодействовать с молекулами воды, отрывая от них катионы водорода H + . Например, сульфид-ион, являясь кислотным остатком слабой сероводородной кислоты, взаимодействует с ней следующим образом:
S 2- + H 2 O ↔ HS − + OH −
HS − + H 2 O ↔ H 2 S + OH −
Как можно видеть, в результате такого взаимодействия образуется избыток гидроксид-ионов, отвечающий за щелочную реакцию среды. То есть кислотные остатки слабых кислот увеличивают щелочность среды. В случае растворов солей содержащих такие кислотные остатки говорят, что для них наблюдается гидролиз по аниону .
Кислотные остатки сильных кислот, в отличие от слабых, с водой не взаимодействуют. То есть они не оказывают влияния на pH водного раствора. Например, хлорид-ион, являясь кислотным остатком сильной соляной кислоты, с водой не реагирует:
То есть, хлорид-ионы, не влияют на pН раствора.
Из катионов металлов, так же с водой способны взаимодействовать только те, которым соответствуют слабые основания. Например, катион Zn 2+ , которому соответствует слабое основание гидроксид цинка. В водных растворах солей цинка протекают процессы:
Zn 2+ + H 2 O ↔ Zn(OH) + + H +
Zn(OH) + + H 2 O ↔ Zn(OH) + + H +
Как можно видеть из уравнений выше, в результате взаимодействия катионов цинка с водой, в растворе накапливаются катионы водорода, повышающие кислотность среды, то есть понижающие pH. Если в состав соли, входят катионы, которым соответствуют слабые основания, в этом случае говорят что соль гидролизуется по катиону .
Катионы металлов, которым соответствуют сильные основания, с водой не взаимодействуют. Например, катиону Na + соответствует сильное основание – гидроксид натрия. Поэтому ионы натрия с водой не реагируют и никак не влияют на pH раствора.
Таким образом, исходя из вышесказанного соли можно разделить на 4 типа, а именно, образованные:
1) сильным основанием и сильной кислотой,
Такие соли не содержат ни кислотных остатков, ни катионов металлов, взаимодействующих с водой, т.е. способных повлиять на pH водного раствора. Растворы таких солей имеют нейтральную реакцию среды. Про такие соли говорят, что они не подвергаются гидролизу .
Примеры: Ba(NO 3) 2 , KCl, Li 2 SO 4 и т.д.
2) сильным основанием и слабой кислотой
В растворах таких солей, с водой реагируют только кислотные остатки. Среда водных растворов таких солей щелочная, в отношении солей такого типа говорят, что они гидролизуются по аниону
Примеры: NaF, K 2 CO 3 , Li 2 S и т.д.
3) слабым основанием и сильной кислотой
У таких солей с водой реагируют катионы, а кислотные остатки не реагируют – гидролиз соли по катиону , среда кислая.
Примеры: Zn(NO 3) 2 , Fe 2 (SO 4) 3 , CuSO 4 и т.д.
4) слабым основанием и слабой кислотой.
С водой реагируют как катионы, так и анионы кислотных остатков. Гидролиз солей такого рода идет и по катиону, и по аниону или же. Также говорят про такие соли, что они подвергаются необратимому гидролизу .
Что же значит то, что они необратимо гидролизуются?
Поскольку в данном случае с водой реагируют и катионы металла (или NH 4 +) и анионы кислотного остатка, в раcтворе одновременно возникают и ионы H + , и ионы OH − , которые образуют крайне малодиссоциирующее вещество – воду (H 2 O).
Это, в свою очередь, приводит к тому, что соли образованные кислотными остатками слабых оснований и слабых кислот не могут быть получены обменными реакциями, а только твердофазным синтезом, либо и вовсе не могут быть получены. Например, при смешении раствора нитрата алюминия с раствором сульфида натрия, вместо ожидаемой реакции:
2Al(NO 3) 3 + 3Na 2 S = Al 2 S 3 + 6NaNO 3 (− так реакция не протекает!)
Наблюдается следующая реакция:
2Al(NO 3) 3 + 3Na 2 S + 6H 2 O= 2Al(OH) 3 ↓+ 3H 2 S + 6NaNO 3
Тем не менее, сульфид алюминия без проблем может быть получен сплавлением порошка алюминия с серой:
2Al + 3S = Al 2 S 3
При внесении сульфида алюминия в воду, он также как и при попытке его получения в водном растворе, подвергается необратимому гидролизу.
Al 2 S 3 + 6H 2 O = 2Al(OH) 3 ↓ + 3H 2 S
Химическим путем рН раствора можно определить при помощи кислотно-основных индикаторов.
Кислотно-основные индикаторы – органические вещества, окраска которых зависит от кислотности среды.
Наиболее распространенными индикаторами являются лакмус, метиловый оранжевый, фенолфталеин. Лакмус в кислой среде окрашивается в красный цвет, в щелочной – в синий. Фенолфталеин в кислой среде - бесцветный, в щелочной окрашивается в малиновый цвет. Метиловый оранжевый в кислой среде окрашивается в красный цвет, а в щелочной – в желтый.
В лабораторной практике часто смешивают ряд индикаторов, подобранных таким образом, чтобы цвет смеси изменялся в широких пределах значений рН. С их помощью можно определить рН раствора с точностью до единицы. Эти смеси называют универсальными индикаторами .
Имеются специальные приборы – рН–метры, с помощью которых можно определить рН растворов в диапазоне от 0 до 14 с точностью до 0,01 единицы рН.
Гидролиз солей
При растворении некоторых солей в воде нарушается равновесие процесса диссоциации воды и, соответственно, изменяется рН среды. Это объясняется тем, что соли реагируют с водой.
Гидролиз солей – химическое обменное взаимодействие ионов растворенной соли с водой, приводящее к образованию слабодиссоциирующих продуктов (молекул слабых кислот или оснований, анионов кислых солей или катионов основных солей) и сопровождающееся изменением рН среды.
Рассмотрим процесс гидролиза в зависимости от природы оснований и кислот, образующих соль.
Соли, образованные сильными кислотами и сильными основаниями (NaCl, kno3, Na2so4 и др.).
Допустим , что при взаимодействии хлорида натрия с водой происходит реакция гидролиза с образованием кислоты и основания:
NaCl + H 2 O ↔ NaOH + HCl
Для правильного представления о характере этого взаимодействия запишем уравнение реакции в ионном виде, учитывая, что единственным слабодиссоциирующим соединением в этой системе является вода:
Na + + Cl - + HOH ↔ Na + + OH - + H + + Cl -
При сокращении одинаковых ионов в левой и правой частях уравнения остается уравнение диссоциации воды:
Н 2 О ↔ Н + + ОН -
Как видно, в растворе нет избыточных ионов Н + или ОН - по сравнению с их содержанием в воде. Кроме того, никаких других слабодиссоциирующих или труднорастворимых соединений не образуется. Отсюда делаем вывод, что соли, образованные сильными кислотами и основаниями гидролизу не подвергаются, а реакция растворов этих солей такая же, как и в воде, нейтральная (рН=7).
При составлении ионно–молекулярных уравнений реакций гидролиза необходимо:
1) записать уравнение диссоциации соли;
2) определить природу катиона и аниона (найти катион слабого основания или анион слабой кислоты);
3) записать ионно-молекулярное уравнение реакции, учитывая, что вода - слабый электролит- и что сумма зарядов должна быть одинаковой в обеих частях уравнения.
Соли, образованные слабой кислотой и сильным основанием
(Na 2 CO 3 , K 2 S, CH 3 COONa и др .)
Рассмотрим реакцию гидролиза ацетата натрия. Эта соль в растворе распадается на ионы: CH 3 COONa ↔ CH 3 COO - + Na + ;
Na + -катион сильного основания, CH 3 COO - - анион слабой кислоты.
Катионы Na + не могут связывать ионы воды, так как NaОН – сильное основание - полностью распадается на ионы. Анионы слабой уксусной кислоты CH 3 COO - связывают ионы водорода с образованием малодиссоциированной уксусной кислоты:
CH 3 COO - + НОН ↔ CH 3 COOН + ОН -
Видно, что в результате гидролиза CH 3 COONa в растворе образовался избыток гидроксид-ионов, и реакция среды стала щелочной (рН > 7).
Таким образом можно сделать вывод, что соли, образованные слабой кислотой и сильным основанием гидролизуются по аниону ( An n - ). При этом анионы соли связывают ионы Н + , а в растворе накапливаются ионы ОН - , что обуславливает щелочную среду (рН>7):
An n - + HOH ↔ Han (n -1)- + OH - , (при n=1 образуется HAn – слабая кислота).
Гидролиз солей, образованных двух- и трехосновными слабыми кислотами и сильными основаниями, протекает ступенчато
Рассмотрим гидролиз сульфида калия. К 2 S диссоциирует в растворе:
К 2 S ↔ 2К + + S 2- ;
К + - катион сильного основания, S 2 - анион слабой кислоты.
Катионы калия не принимают участия в реакции гидролиза, взаимодействуют с водой только анионы слабой сероводородной кислоты. В данной реакции по первой ступени происходит образование слабодиссоциирующих ионов HS - , по второй ступени – образование слабой кислоты H 2 S:
1-я ступень: S 2- + HOH ↔ HS - + OH - ;
2-я ступень: HS - + HOH ↔ H 2 S + OH - .
Образующиеся по первой ступени гидролиза ионы ОН - значительно снижают вероятность гидролиза по следующей ступени. В результате практическое значение обычно имеет процесс, идущий только по первой ступени, которым, как правило, и ограничиваются при оценке гидролиза солей в обычных условиях.
Урок, проводимый с использованием тетради для практических работ И.И.Новошинского, Н.С.Новошинской к учебнику Химия 8 класс в МОУ “СОШ №11” г. Северодвинска Архангельской области учителем химии О.А.Олькиной в 8 классах (на параллели).
Цель урока: Формирование, закрепление и контроль умений учащихся определять реакцию среды растворов с помощью различных индикаторов, в том числе природных, используя тетрадь для практических работ И.И.Новошинского, Н.С.Новошинской к учебнику Химия 8 класс.
Задачи урока:
- Образовательные. Закрепить следующие понятия индикаторы, реакция среды (типы) , pH, фильтрат, фильтрование на основе выполнения заданий практической работы. Проверить знания учащихся, которые отражают зависимость “ раствор вещества (формула) – значение pH (числовое значение) – реакция среды”. Рассказать учащимся о способах снижения кислотности почв Архангельской области.
- Развивающие. Способствовать развитию логического мышления учащихся на основании анализа результатов, полученные в ходе практической работы, их обобщения, а также умения делать вывод. Подтвердить правило: практика доказывает теорию или опровергает ее. Продолжить формирование эстетических качеств личность учащихся на основе разнообразного спектра представленных растворов, а также поддержать интерес ребят к изучаемому предмету “Химия”.
- Воспитывающие. Продолжить формировать умения учащихся выполнять задания практической работы, придерживаясь, правил по охране труда и технике безопасности, в том числе правильно выполнять процессы фильтрования, нагревания.
Практическая работа № 6 “Определение pH среды”.
Цель для учащихся: Научится определять реакцию среды растворов разных объектов (кислот, щелочей, солей, почвенного раствора, некоторых растворов и соков), а также изучить растительные объекты как природные индикаторы.
Оборудование и реактивы: штатив с пробирками, пробка, стеклянная палочка, штатив с кольцом, фильтровальная бумага, ножницы, химическая воронка, стаканы, фарфоровая ступка с пестиком, мелкая терка, чистый песок, универсальная индикаторная бумага, испытуемый раствор, почва, кипяченая вода, плоды, ягоды и другой растительный материал, раствор гидроксида натрия и серной кислоты, хлорида натрия.
Ход урока
Ребята! Мы с вами уже познакомились с такими понятиями как реакция среды водных растворов, а также индикаторы.
Какие типы реакции среды водных растворов вы знаете?
- нейтральная, щелочная и кислотная.
Что такое индикаторы?
- вещества, с помощью которых можно определить реакцию среды.
Какие индикаторы вам известны?
- в растворах: фенолфталеин, лакмус, метиловый оранжевый.
- сухие: универсальная индикаторная бумага, лакмусовая бумага, метилоранжевая бумага
Какими способами можно определить реакцию среды водных растворов?
- влажным и сухим.
Что такое pH среды?
- водородный показатель ионов водорода в растворе(pH=– lg )
Давайте вспомним, какой ученый ввел понятие pH среды?
- Датский химик Сёренсен.
Молодцы!!! Теперь откройте тетрадь для практических работ на с.21 и прочитайте задание №1 .
Задание №1.Определите pH раствора при помощи универсального индикатора.
Вспомним правила при работе с кислотами и щелочами!
Выполните опыт из задания №1.
Сделайте вывод. Таким образом, если раствор имеет pH = 7 среда нейтральная, при pH < 7 среда кислотная, при pH > 7 среда щелочная.
Задание №2.Получите почвенный раствор и определите его pH при помощи универсального индикатора.
Прочитайте задание на с.21-с.22, выполните задание по плану, результаты занесите в таблицу.
Вспомним правилами безопасности при работе с нагревательными приборами (спиртовкой).
Что такое фильтрование?
- процесс разделение смеси, который основан на различной пропускной способности пористого материала – фильтрата по отношению к составляющим смесь частицам.
Что такое фильтрат?
- это прозрачный раствор, получаемый после фильтрования.
Результаты оформите в виде таблицы.
Какая реакция среды почвенного раствора?
- Кислая
Что необходимо сделать, чтобы повысить качество почвы в нашем регионе?
- CaCO 3 + H 2 O+CO 2 = Ca(HCO 3) 2
Внесение удобрений, которые имеют щелочную реакцию среды: молотый известняк и других карбонатных минералов: мела, доломита. В Пинежском районе Архангельской области есть залежи такого минерала, как известняк, вблизи карстовых пещер, поэтому он доступен.
Сделайте вывод. Реакция среды полученного почвенного раствора pH=4,слабокислая, следовательно, для повышения качества почвы необходимо известкование.
Задание №3. Определите pH некоторых растворов и соков при помощи универсального индикатора.
Прочитайте задание на с.22, выполните задание по алгоритму, результаты занесите в таблицу.
Источник сока |
Источник сока |
||
Картофель |
Силикатный клей |
||
Капуста свежая |
Столовый уксус |
||
Капуста квашеная |
Раствор питьевой соды |
||
Апельсин |
|||
Свекла свежая |
|||
Свекла вареная |
Сделайте вывод. Таким образом, разные натуральные объекты имеют разные значения pH: pH 1?7– среда кислотная (лимон, клюква, апельсин, помидор, свекла, киви, яблоко, банан, чай, картофель, капуста квашеная, кофе, силикатный клей).
pH 7?14среда щелочная(капуста свежая, раствор питьевой соды).
pH = 7 среда нейтральная(хурма, огурец, молоко).
Задание №4. Изучите растительные индикаторы.
Какие растительные объекты могут выступать в качестве индикаторов?
- ягоды: соки, лепестки цветов: вытяжки, соки овощей: корнеплодов, листьев.
- вещества, которые могут изменять окраску раствора в разных средах.
Прочитайте задание на с.23 и выполните его по плану.
Результаты оформите в таблицу.
Растительный материал (природные индикаторы) |
Цвет раствора природного индикатора |
||
Кислотная среда |
Естественный цвет раствора (нейтральная среда) |
Щелочная среда |
|
Клюква (сок) |
фиолетовый |
||
Клубника (сок) |
оранжевый |
персиково – розовый |
|
Черника (сок) |
красно-фиолетовый |
сине – фиолетовый |
|
Черная смородина (сок) |
красно-фиолетовый |
сине – фиолетовый |
|
Сделайте вывод. Таким образом, в зависимости от pH среды природные индикаторы: клюква (сок), клубника (сок), черника (сок), черная смородина (сок) приобретают следующие цвета: в кислой среде – красный и оранжевый цвет, в нейтральной – красный, персиково – розовый и фиолетовый цвета, в щелочной среде от розового через сине – фиолетовый до фиолетового цвета.
Следовательно, по интенсивности окраски природного индикатора можно судить по реакции среды того или иного раствора.
По окончании работы приведите в порядок рабочее место.
Ребята! Сегодня был очень необычный урок! Вам понравился?! Можно ли использовать сведения, полученные на данном уроке в повседневной жизни?
Сейчас выполните задание, которое приведено в ваших тетрадях для практических работ.
Задание для контроля. Распределите вещества, формулы которых приведены ниже, по группам в зависимости от pH их растворов: HCl, H 2 O, H 2 SO 4 , Ca (OH) 2 , NaCl, NaOH, KNO 3 , H 3 PO 4 , KOH.
pH 17– среда (кислотная) ,имеют растворы (HCl,H 3 PO 4 ,H 2 SO 4) .
pH 714 среда(щелочная), имеют растворы (Ca(OH) 2 , KOH, NaOH).
pH = 7 среда (нейтральная), имеют растворы (NaCl, H 2 O,KNO 3).
Оценка за работу_______________